制药行业的校准

什么是数据完整性?为什么它如此重要和尖锐?违约会导致什么?什么是ALCOA Plus?
作为一个概念,数据完整性这绝不是一个新问题,它已经存在了几十年。总之,在本文中,我们更多地从校准过程的角度来看待数据完整性,并主要关注制药和监管行业。首先,我们看一下数据完整性的一般情况;它是什么,为什么重要,泄露会导致什么。本文还简要讨论了ALCOA +的概念。
我记得在90年代早期,我们有制药客户在购买校准软件之前对我们进行审计,数据完整性已经是这种供应商审计期间讨论的正常主题之一。因此,这不是一个新话题,尽管最近变得更加尖锐。
按下图下载相关免费白皮书:
这都是信任的问题
通常,当我们购买日常用品时,我们可以很快看到产品是否运行正常,或者是否有故障。例如,如果你买了一台新电视,打开它,你可以很快看到它是否工作。但是对于不同的产品,要判断你的产品是否合适就不那么容易了。在药物方面尤其如此。当你拿起一种药物时,如何知道它是一种根据设计规范正常工作的产品?在大多数情况下,你无法判断这一点,所以这一切都与信任有关——你必须能够相信你吃的药是合适的。
什么是数据完整性?
在药品质量体系中,数据完整性是确保产品达到所需质量的基础。
在每一个过程中,都会产生大量的数据。数据完整性是指数据在其整个生命周期内的准确性和一致性的维护和保证。它是任何存储、处理或检索数据的系统的设计、实现和使用的关键方面。术语数据完整性被广泛使用,在不同的上下文中有不同的含义。这个术语本身已经相当古老了,最初被用于计算领域。药品制造商收集和记录的数据的完整性对于确保生产高质量和安全的产品至关重要。为确保数据的完整性,应防止意外或故意修改、伪造和删除数据。
对于流程工业中的许多流程,您不能简单地测试最终产品,看看它是否是一个合适的产品。相反,您必须确保过程中的条件是正确的,以便生产正确的产品。这些关键条件自然必须被记录和维护,以确保它们是正确的。在制药厂的许多工序中都是如此。
为什么现在数据完整性很重要?
数据完整性最近已经上升到一个比以前更重要的话题。
数据完整性相关违规行为导致了几起监管行动如警告信和进口警告。事实上,FDA最近发布的大量警告信都与数据完整性有关。
随着国际监管机构越来越关注数据完整性,FDA、wow和MHRA审核员已经接受了更好地识别数据完整性问题的培训。
MHRA(英国药品和保健产品监管机构)最近发布了新的指南“GMP数据完整性定义和行业指南”(2015年3月)。制药公司必须在2017年底前遵守该规定。此外,FDA还发布了“数据完整性和符合CGMP -行业指南”(2016年4月)。这还在草案阶段,但已经进入了评论阶段。这两种情况自然会对制药业产生影响。当然,在此之前已经有了良好生产规范(CGMP)的指导,例如21 CFR部件(210,211和212),讨论了数据完整性相关的问题,但这些都被提到了新的法规更新将提高人们的关注。
数据完整性受到更多关注的另一个原因是在校准过程中增加使用移动设备.这包括在平板电脑和手机上使用的应用程序。它还包括增加使用记录校准器,在校准过程中自动将校准结果存储在其存储器中,并将此数据传输到校准软件。由于自动记录校准器的使用将改善校准系统的业务案例,因此它们正在得到更广泛的应用。要了解更多关于什么是记录校准器以及它如何有益于校准过程,请查看之前的博客文章:什么是文档校准器?使用它有什么好处?
因此,数据完整性问题变得越来越突出。
破坏数据完整性的影响
违反数据完整性的影响可以看作是对客户的影响和对制药公司的影响。
为客户其影响可能是药物没有达到所需的效果,患者的安全可能受到损害,在最坏的情况下,甚至可能导致生命损失。
为制药公司影响可以是;FDA的警告信,禁止生产许可证,负面声誉,失去客户信心,市场份额下降,股价下跌。
因此,数据完整性被破坏的影响可能是巨大的。
意外的/故意的
可能会破坏数据完整性偶然的还是故意的.通常涉及计算机化系统来处理数据,用户可能不知道这种系统中的任何问题。当然,大多数数据完整性问题都是偶然的和无意的。无论如何,在FDA的一些警告信中,我们可以看到在最糟糕的情况下,甚至存在故意伪造记录的情况。
实现更好数据完整性的主要步骤
许多制药公司似乎都认为提高数据完整性的主要步骤是:
- 更好的教育和交流
- 发现和减轻风险
- 专注于技术和IT系统
- 数据完整性的治理
ALCOA和ALCOA plus
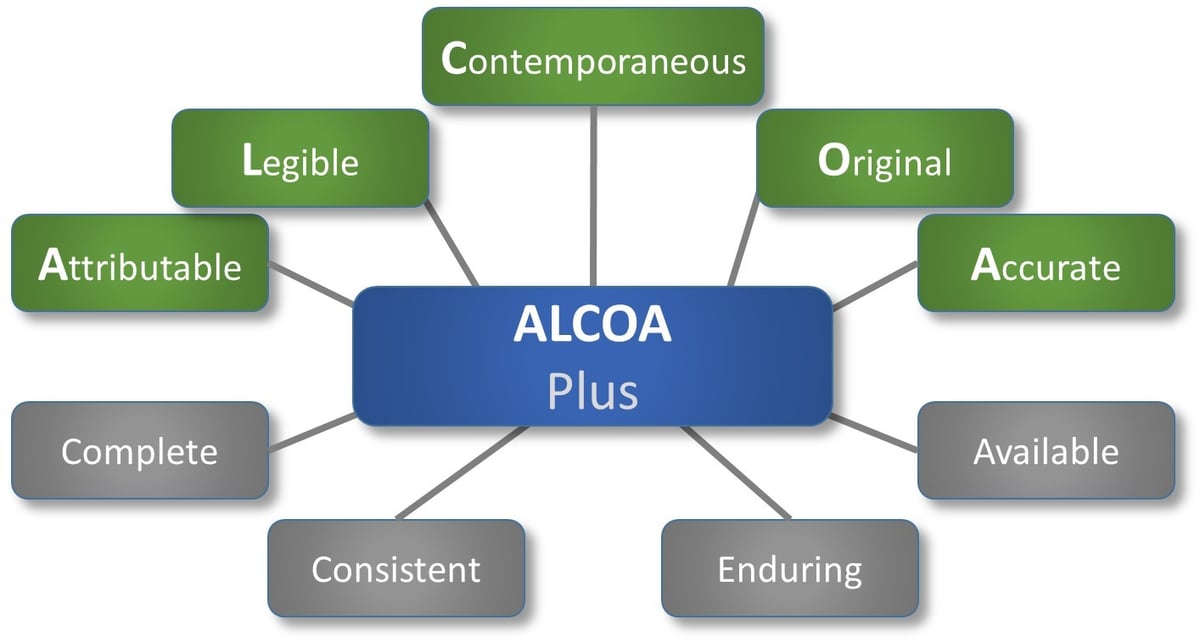
首字母缩写美国铝业自20世纪90年代以来就已经存在,被规范行业用作确保数据完整性的框架,并且是良好文档实践(GDP)的关键。ALCOA涉及纸质或电子数据,FDA指南将其定义为:
- 由于
- 易读的
- 同生
- 原始
- 准确的
更新的美国铝业(ALCOA) +广告的几个属性列表:
- 完整的
- 一致的
- 持久的
- 可用
欲了解更多关于ALCOA Plus的详细描述,请参阅相关的免费白皮书。
什么会导致数据完整性问题?
在任何系统中,可能导致数据完整性问题的一些实际和非常普遍的事情是,例如:缺乏培训、用户特权、糟糕的或共享的密码、计算机化系统的控制、不完整的数据输入,以及缺乏更改和修改的审计数据记录。
消费者要避免的第一个陷阱——骗药
虽然对行业来说并不是真正的数据完整性问题,但对消费者来说这是一个重要的问题。现在人们越来越多地在网上购物,你也可以在网上买到药品,但不幸的是,你并不总是能买到你点的东西。网上购买的大量药品都是假货。有时包装显然是不合适的,所以很明显,药物是一个骗局。但不幸的是,情况并非总是如此,人们有时确实会食用假冒药品。很明显,欺诈药物不能提供预期的治疗,但它也对我们的安全构成了巨大的风险,更糟糕的是,它甚至可能是致命的。
新规定的产品包装,以避免欺诈药品
为了更好地控制欺诈药品,欧洲药品管理局(EMA)最近出台了一项新规定,要求所有(除三个)欧盟国家的所有处方药制造商在2019年2月之前在其产品包装上加入新的安全特性。该规定是欧盟打击假药的更广泛努力的一部分,将要求制药商在大多数中央授权产品的包装上添加唯一标识符和防篡改装置。这自然增加了药品制造商的负担和成本,建立系统来支持这一点,但这肯定对客户有利。虽然这一具体规定是针对欧盟地区的,但它将在全球范围内产生影响。
结论
虽然数据完整性的概念已经存在很长时间了,但最近由于数据完整性问题而变得更加尖锐移动工具的使用而且增加监管机构的关注.尽管最终,数据完整性是一种常识——在整个生命周期中确保数据的完整性——但在使用各种系统和工具的实践中,它变得更加复杂。由于破坏数据完整性的影响可能是巨大的,因此这是具有高优先级的事情。
在后面的另一篇博客文章中,我将探讨更实际的事情,比如在正常的过程校准环境中,是什么会导致数据完整性问题,是基于纸张的系统还是无纸化系统,是内包的还是外包的。
Beamex相关产品
使用Beamex MC6文档校准器用“安全+可选功能确保整个校准过程中校准数据的完整性,当与Beamex CMX校准管理软件.
相关有用参考资料
21 CFR第11部,电子纪录;电子签名:
http://www.fda.gov/RegulatoryInformation/Guidances/ucm125067.htm
MHRA GMP数据完整性定义和行业指南,2015年3月:
https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/412735/Data_integrity_definitions_and_guidance_v2.pdf
数据完整性和符合CGMP指南行业指南草案,2016年4月:
http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm495891.pdf
FDA警告信是公开的,可以在这里找到:
http://www.fda.gov/ICECI/EnforcementActions/WarningLetters/default.htm
欧洲药品管理局(EMA)对产品包装的最新规定:
http://www.raps.org/Regulatory-Focus/News/2016/02/09/24281/EU-Regulation-Requires-New-Safety-Features-on-Drug-Packaging-by-2019/





![与Endress+Hauser一起工作车间奇迹[案例故事]](https://2203666.fs1.hubspotusercontent-na1.net/hub/2203666/hubfs/Beamex_blog_pictures/Endress+Hauser%20.jpg?width=300&name=Endress+Hauser%20.jpg)



![英国国家电网加大油门[案例故事]](https://2203666.fs1.hubspotusercontent-na1.net/hub/2203666/hubfs/Beamex_blog_pictures/23GrainLNGTerminalL.jpeg?width=300&name=23GrainLNGTerminalL.jpeg)
![校准管理和软件[电子书]。](https://2203666.fs1.hubspotusercontent-na1.net/hub/2203666/hubfs/Beamex_blog_pictures/Calibration%20software%20ebook%20Beamex.jpg?width=300&name=Calibration%20software%20ebook%20Beamex.jpg)