作为制药公司产品的消费者,我们都希望确保我们可以信任他们生产的产品。幸运的是,制药公司受到严格的监管,它们的运作一直受到监控。美国食品和药物管理局(FDA)是定期审计全球制药公司以确保其合规的主要机构。
每年,FDA都会向未能遵守规定的制药公司发出数百次警告。所以即使他们也不完美!这些警告大多与校准无关,但也有一些与校准有关。我分析了与校准相关的警告,在本文中,我列出了最常见的校准相关警告。如果这听起来很有趣,请继续阅读。
目录
我建议浏览整篇文章,但你也可以直接跳到带下划线的主要主题:
FDA简介
食品及药物管理局(https://www.fda.gov/)是一家美国政府机构,通过确保药物、生物制品和医疗设备的安全性、有效性和安全性来保护公众健康。
FDA对制药公司进行审计,并确保他们按照相关法规运作。尽管FDA是美国的权威机构,但任何想要在美国销售产品的制药公司都需要遵守FDA的规定,并接受他们的审计程序。因此,在实践中,FDA的要求是全球性的。
如果FDA在审计过程中发现不合规的证据,他们将发出表格483,这可能会导致一封警告信。如果发现严重违规行为,FDA甚至有权关闭工厂。
所以,很明显,当FDA审核员来的时候,制药公司都很紧张。
除了FDA,还有其他机构对制药公司进行审计,包括欧洲药品管理局(EMA)和英国药品和保健产品监管局(MHRA),以及其他国家的国家机构。所以,除了FDA,制药公司还要接受其他机构的定期审计。
希望当局之间的多边承认协议(MRA)继续发展,这样制药公司就不会受到不同当局的多次审计。
警告信
如前所述,当FDA审核员调查一家制药公司时,不合规的观察结果将被写入483表格。根据他们的临界性和/或观察的数量,可以导致一封警告信。然后,制药公司必须对信件做出回应,并采取足够的纠正措施来纠正观察结果。
这些警告是公开的,可以在FDA网站上通过以下链接找到:https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/warning-letters
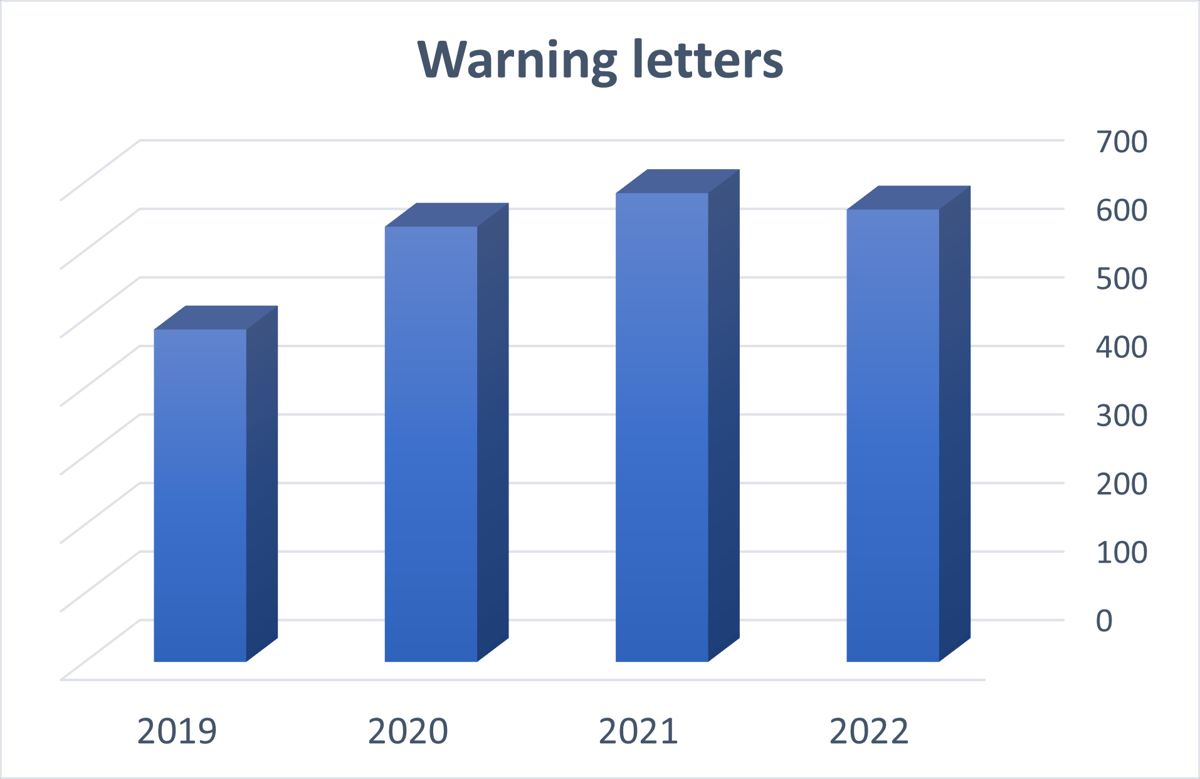
从2019年到现在,FDA网站上列出了近3000封警告信。
在过去三年里,每年大约发出600封警告信,分布如下图所示:
最常见的一般性警告
由于有这么多的字母,分析它们变得很复杂,但一般现有的信息列出了警告的最常见原因:
- 没有书面程序,或不遵守书面程序
- 数据记录和数据完整性问题
- 生产工艺验证-缺乏生产控制
- 虚假或误导性广告
- 环境监测的问题
许多通常被称为“不符合良好生产规范”。
最常见的与校准相关的警告信
这篇文章不是关于所有的警告信,只是那些在某种程度上与校准有关的警告信。不用说,我最感兴趣的是校准相关的主题
所以,我调查了过去三年的所有警告:2020年、2021年和2022年。在这三年中,已经发出了近2000封警告信!
如果我们看看有多少警告信与校准有关,我们可以看到它实际上是相当温和的警告。大约2%的警告信包含对校准的评论。
虽然这些公司大多位于美国,但也有一些来自南美、欧洲和亚洲。
显然,一些通用警告也可以包含校准,尽管没有单独提到。这些问题包括与维护相关的问题,书面程序缺失,数据记录和制造控制问题,仅举几例。
我分析了所有警告信中提到的校准。让我们来看看什么样的校准相关的主题似乎是最常见的。
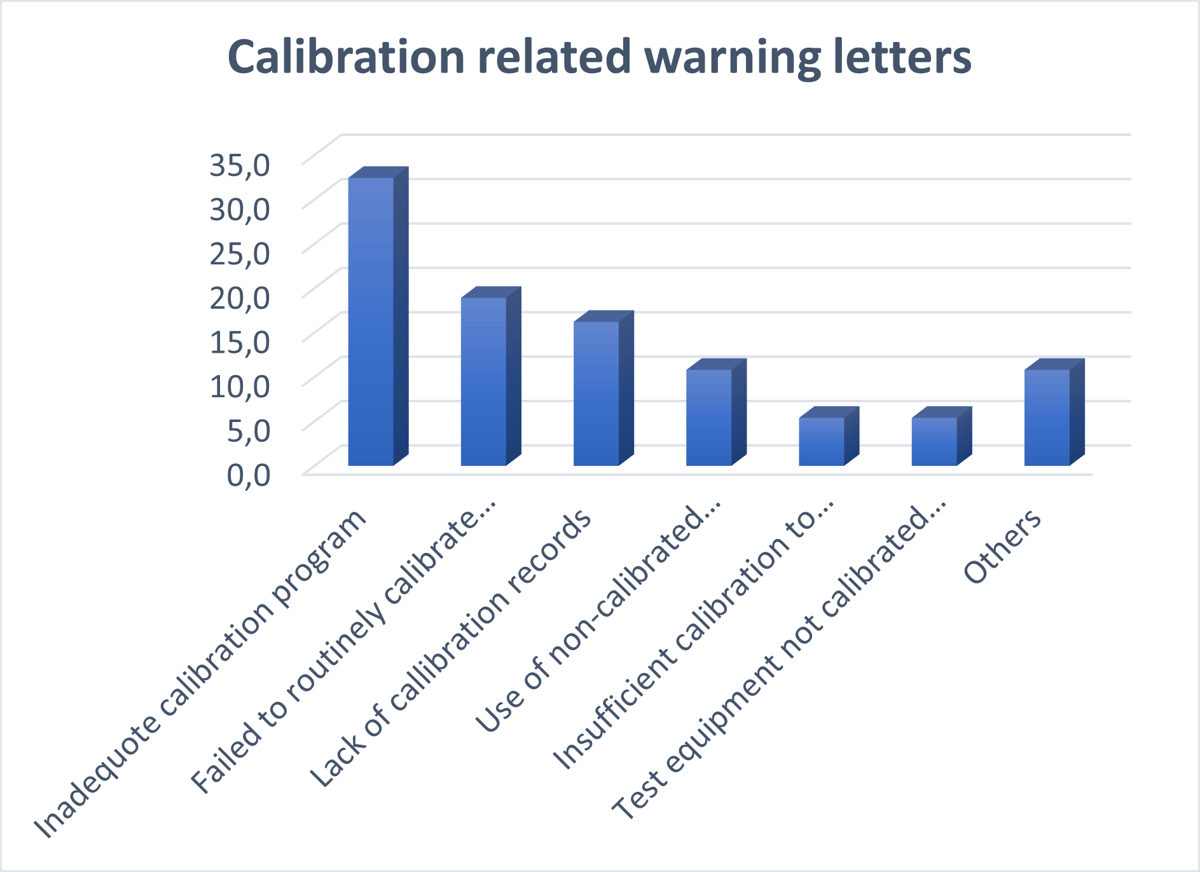
我将与校准相关的警告分为以下类别,它们的份额如下表所示:
- 校准程序不充分:33%
- 未常规校准仪器:19%
- 缺乏校准记录:16%
- 使用未经校准的校准仪器:11%
- 校准不足,无法证明所需精度:5%
- 测试设备未按要求范围校准:5%
- 其他:11%
下图说明了最常见的校准相关警告。
校准相关警告的三大原因以及如何避免它们
让我们来看看前三个原因以及如何避免它们。
1.校准程序不充分
我们可以看到,最常见的原因是“校准程序不充分”,占案例的三分之一(33%)。在这些情况下,公司没有足够的校准程序来记录如何以及何时校准每台仪器。
创建和记录校准程序是校准工作人员的基本工作。它自然会变得更加苛刻,以确保它对FDA审核员来说是“足够的”,并满足所有相关的FDA法规。
2.未能定期校准仪器
第二个最常见的原因是“没有定期校准仪器”,占19%。在这些情况下,该公司只是没有按照他们应该做的那样校准所有仪器。
解决这个问题的最好办法是确保你有一个自动系统,当仪器应该校准时,它会提醒你,并确保所有的校准都完成了。
3.缺乏校准记录
第三个最常见的原因是“缺乏校准记录”,占16%。这意味着该公司没有证据表明正在进行校准。这种情况与前一种情况非常相似,但在这种情况下,公司以某种方式能够说服审核员,他们已经进行了校准,但他们没有记录来证明这一点,例如校准证书。
解决这个问题的方法是确保您的校准系统以数字方式存储所有校准,以便在审核员想要查看它们的任何时候都可以轻松地取出记录。
Beamex如何提供帮助
长期以来,我们一直与许多顶级制药公司合作。许多世界领先的制药和生命科学公司都依赖Beamex校准生态系统,该系统旨在帮助客户实现与校准相关的目标,符合法规,如FDA。
我们为校准生态系统开发的许多功能都是为了满足制药公司的要求。
例如,对于制药公司,我们提供:
- 校准管理软件具有许多功能,特别为制药公司开发
- 用于现场和车间校准的校准设备
- 为制药公司量身定制的各种专家服务
如果您从事制药行业,请联系我们,了解我们如何帮助您满足与校准相关的FDA要求:
相关阅读
如果你觉得这篇文章很有趣,你可能也会喜欢这些:
下载校准要点软件电子书欲了解更多有关校准管理及软件的资料:







![与Endress+Hauser一起工作车间奇迹[案例故事]](https://2203666.fs1.hubspotusercontent-na1.net/hub/2203666/hubfs/Beamex_blog_pictures/Endress+Hauser%20.jpg?width=300&name=Endress+Hauser%20.jpg)



![英国国家电网加大油门[案例故事]](https://2203666.fs1.hubspotusercontent-na1.net/hub/2203666/hubfs/Beamex_blog_pictures/23GrainLNGTerminalL.jpeg?width=300&name=23GrainLNGTerminalL.jpeg)
![校准管理和软件[电子书]。](https://2203666.fs1.hubspotusercontent-na1.net/hub/2203666/hubfs/Beamex_blog_pictures/Calibration%20software%20ebook%20Beamex.jpg?width=300&name=Calibration%20software%20ebook%20Beamex.jpg)